
clínica. Por ejemplo, como se muestra en la
figura 18-30A-C 8 5 ,la
exactitud de la cantidad de fentanilo administrado según el modelo
farmacocinético de Scott y Stansk
i 30es mucho mejor que el admi-
nistrado según el modelo farmacocinético presentado por McClain
y Hu
g 90. Glass y cols
. 58estudiaron el funcionamiento de un dispo-
sitivo de infusión controlado por algoritmo farmacocinético utili-
zando el mismo fentanilo farmacocinético descrito por McClain y
Hug
90 .Demostraron que había una MEAF del 21% y una MEF
de+4% (es decir, un funcionamiento casi completamente sin
sesgos), un funcionamiento mucho mejor que el que demostraron
Shafer y cols
. 85para el mismo grupo farmacocinético. Esto se
explica por las diferencias existentes en la metodología de los estu-
dios, tales como si la muestra ha sido arterial o venosa, si la toma
de muestras ha sido muy rápida tras cambios en la concentración
objetivo o únicamente cuando se ha conseguido un estado seu-
doestacionario, y un grupo de pacientes diferentes (cardíacos
frente a no cardíacos).
Con el objetivo de mejorar el funcionamiento de los sistemas
de infusión controlados por algoritmo farmacocinético, Shafer y
cols
. 85recalcularon los parámetros farmacocinéticos más adecua-
dos del fentanilo directamente a partir de las concentraciones que
se habían obtenido cuando éste se administraba mediante un
sistema de infusión controlado por algoritmo farmacocinético que
utilizaba la farmacocinética de McLean y Hu
g 90. En la
figura 18-30Cse muestran los errores de funcionamiento a lo largo del tiempo
para la farmacocinética óptima del fentanilo estimada para una
población de pacientes (comparado con los de McLean y Hu
g 90y
los de Scott y cols
. 30en el mismo grupo de pacientes). El grupo de
parámetros farmacocinéticos óptimo tiene un error residual
mediano del 21% cuando se mide de forma retrospectiva en el
mismo grupo de enfermos. Este error representa el límite que
impone la variabilidad farmacocinética en el funcionamiento de
cualquier grupo de parámetros para el fentanilo, para calcular la
dosis en una población de adultos. En otras palabras, es poco pro-
bable que ningún grupo de parámetros farmacocinéticos del fen-
tanilo consiga una MEAF inferior al 21%.
Marsh y cols
. 88utilizaron el mismo abordaje para optimizar
el funcionamiento de un sistema de infusión controlado por algo-
ritmo farmacocinético para la administración de propofol a niños.
En un principio usaron un conjunto de parámetros farmacociné-
ticos obtenido de pacientes adultos y obtuvieron una MEAF del
25% y una MEF del –18,5%. Más tarde, obtuvieron una nueva
farmacocinética de propofol para los niños y demostraron de
forma prospectiva que habían logrado reducir la MEAF al 16% con
una variabilidad de menos del 3%. Este funcionamiento es muy
preciso para un sistema de infusión controlado por algoritmo.
Ginsberg y cols
. 91obtuvieron un conjunto de parámetros farmaco-
cinéticos del fentanilo para niños, y Fiset y cols
. 92para el alfenta-
nilo. Muchos estudios han demostrado que los parámetros
farmacocinéticos varían en determinados grupos de pacientes. Por
ejemplo, los parámetros farmacocinéticos del propofol para pacien-
tes sometidos a cirugía a corazón abierto son distintos de los ya
mostrados para la población general. Estos parámetros farmacoci-
néticos para el fentanilo también son diferentes durante la circula-
ción extracorpórea (CEC) y tras la CE
C 93 .De igual forma, el
modelo farmacocinético de Marsh no tiene un funcionamiento
correcto en los pacientes sometidos a trasplante hepático
94 .El interés se ha centrado recientemente en qué otros factores
pueden ser responsables de la variación en los parámetros farma-
Sistemas de administración de fármacos intravenosos
615
18
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
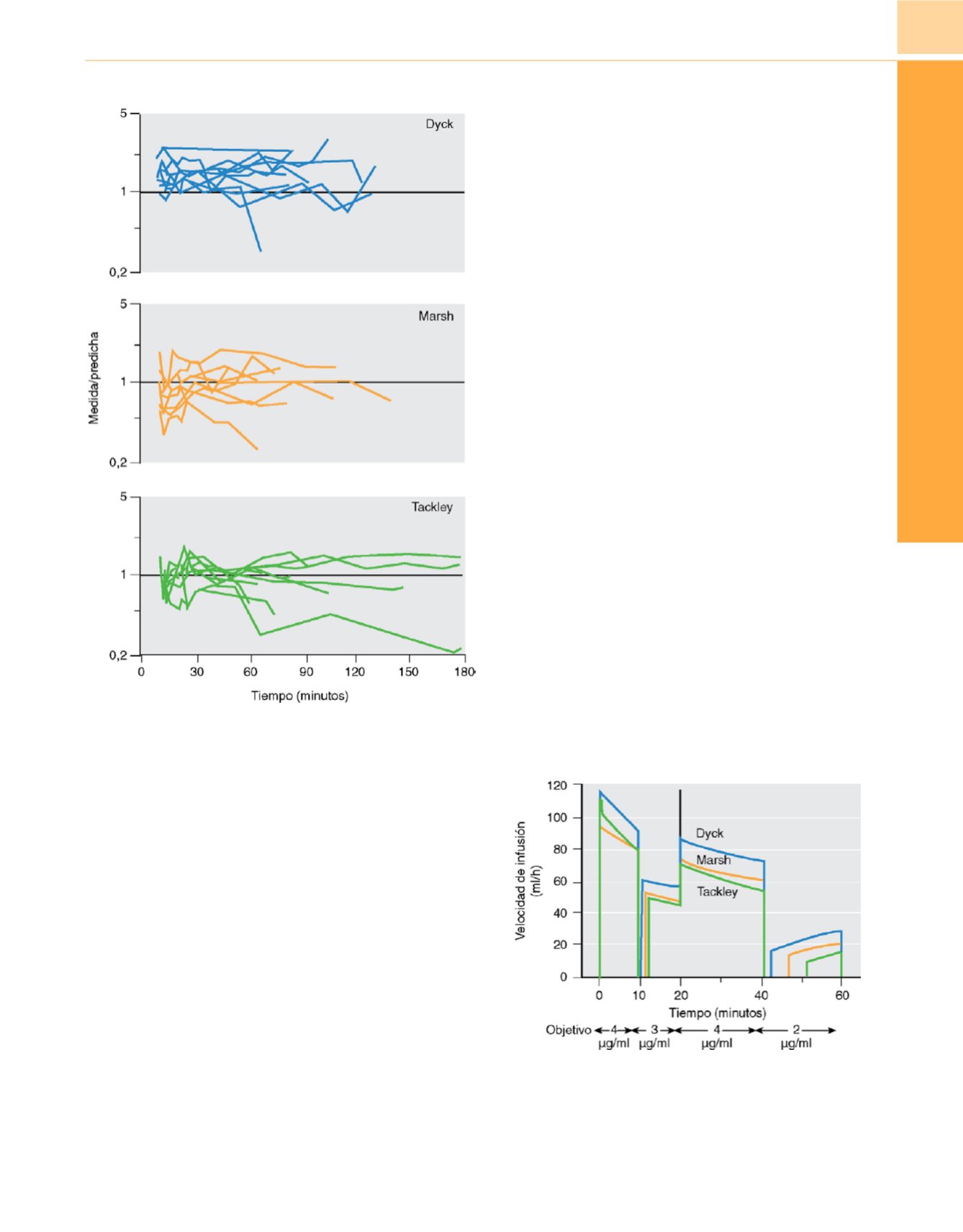
Figura 18-28
Evaluación de tres grupos de parámetros farmacocinéticos
para el propofol. La representación gráfica es la razón entre la concentración
medida y la predicha para muestras obtenidas durante la administración de
propofol con un sistema de infusión mediante control de las concentraciones
finales programado con los parámetros farmacocinéticos descritos por Dyck,
Marsh o Tackley (
n
=10 por grupo). Una razón de 1 significa que la
concentración medida es igual que la predicha. Los parámetros
farmacocinéticos de Dyck tienen un sesgo constantemente positivo.
Figura 18-29
Velocidades de infusión (ml/h) calculadas para alcanzar una
concentración de propofol de 4 (10min), 3 (10min), 4 (20min) y 2
m
g/ml
(20min), calculados con los tres conjuntos de parámetros farmacocinéticos
de Dyck, Marsh y Tackley.









